
彭文静, 万丽娟, 张红梅, 等. 基于MRI特征构建直肠神经内分泌肿瘤病理分级的预测模型[J]. 中华肿瘤杂志, 2022, 44(8):851-857.
DOI: 10.3760/cma.j.cn112152-20220211-00092
目的
探讨MRI特征对直肠神经内分泌肿瘤(NETs)病理分级的预测价值并构建预测模型。
方法
回顾性收集2013年1月至2019年11月在中国医学科学院肿瘤医院经病理证实的直肠NETs患者30例,均行直肠常规MRI平扫、扩散加权成像及动态增强MRI扫描。采用方差分析、Freeman-Halton检验或Kruskal-Wallis H检验比较不同病理分级(G1、G2和G3级)直肠NETs间的临床和MRI特征。对有统计学意义的预测特征行共线性检验,通过逐步回归法移除共线性特征得到最优变量子集后,纳入有序多分类logistic回归分析并建立病理分级预测模型。采用受试者工作特征(ROC)曲线分析评价预测模型对直肠NETs病理分级的预测效能。
结果
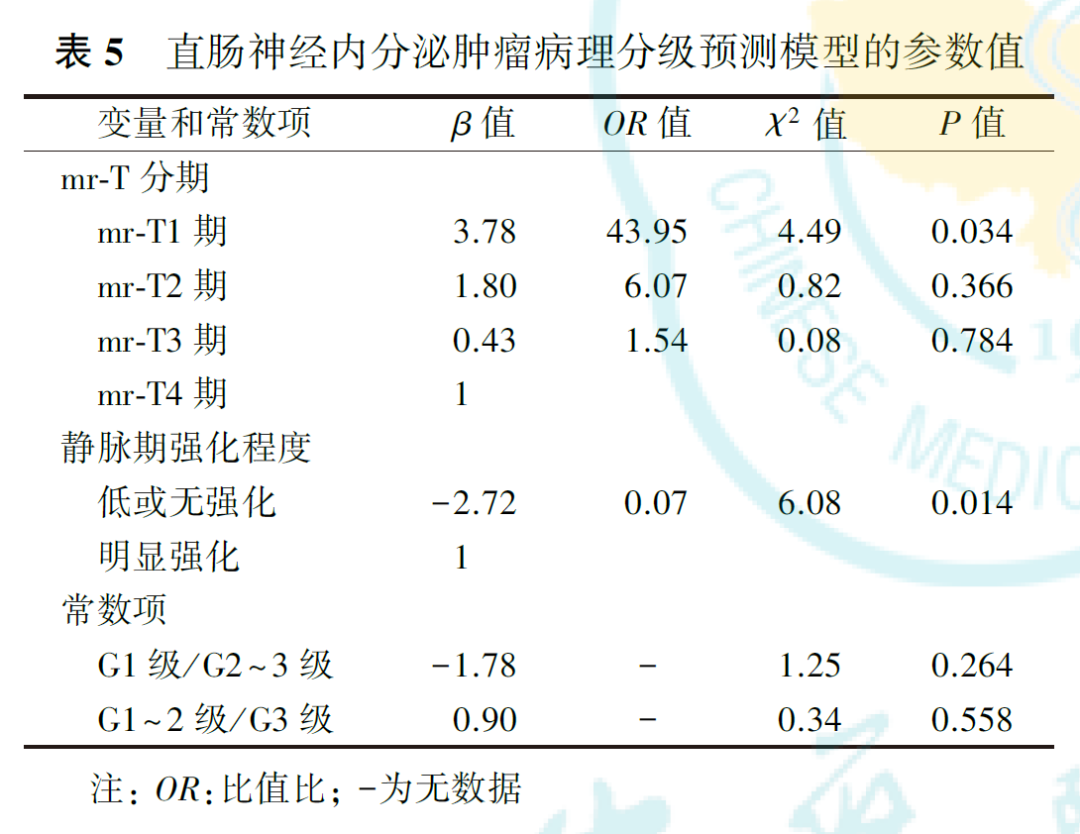
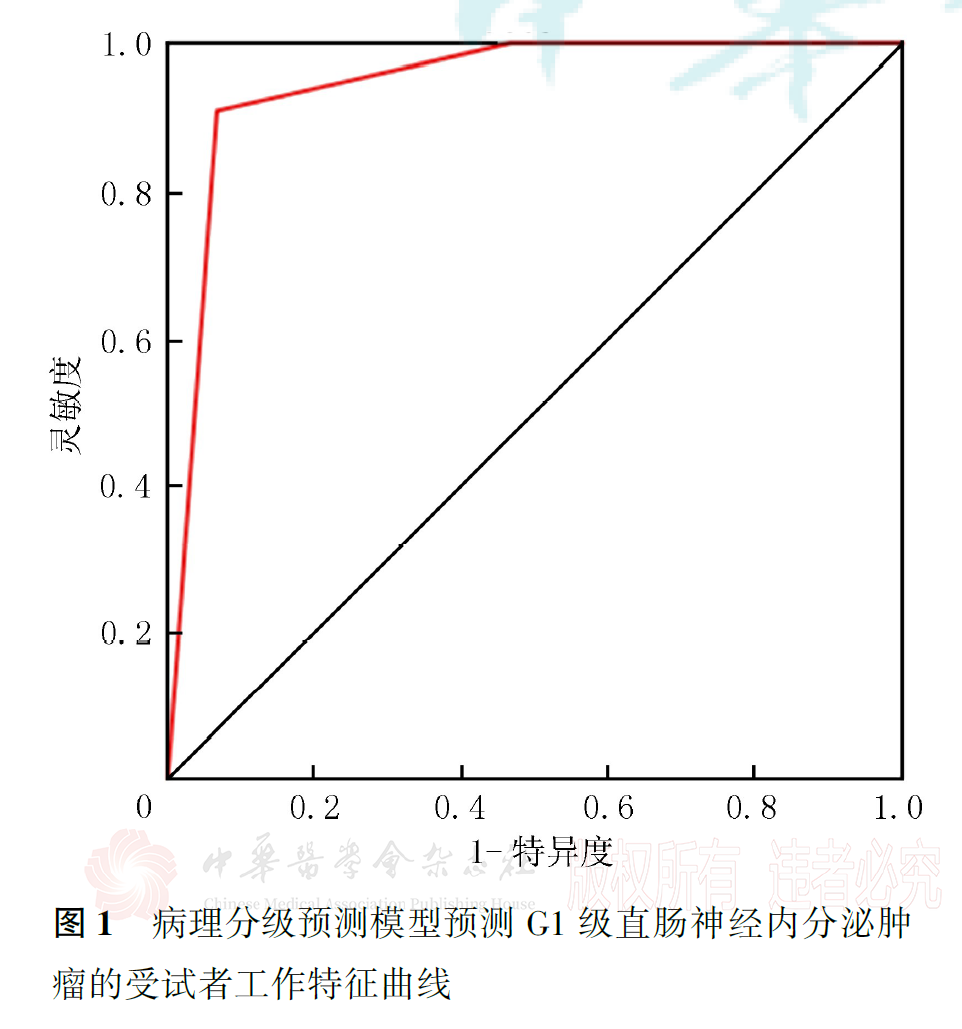
30例直肠NETs中,病理分级为G1级13例,G2级7例,G3级10例。G1、G2和G3级直肠NETs的肿瘤最大径、肿瘤边界、生长方式、mr-T分期、mr-N评价、壁外血管侵犯、系膜筋膜状态、T2加权成像信号强度、静脉期强化程度和有无远处转移差异均有统计学意义(均P<0.05)。经共线性检验和逐步回归法分析,获得含mr-T分期和静脉期肿瘤强化程度的最优预测子集,并构建了病理分级预测模型。相对于mr-T4期,mr-T1期肿瘤病理分级为低级别的OR=43.95(P=0.034);相对于静脉期明显强化,低或无强化肿瘤病理分级为低级别的OR=0.07(P=0.014);G1级与G2~3级二分类预测模型的常数项为-1.78,G1~2级与G3级二分类预测模型的常数项为0.90。应用此模型预测G1、G2和G3级直肠NETs的ROC曲线下面积分别为0.945、0.624和0.896,灵敏度分别为75.0%、85.7%和90.9%,特异度分别为88.9%、52.6%和93.3%。
结论
基于mr-T分期和静脉期肿瘤强化程度的预测模型可以在治疗前预测直肠NETs的病理分级。
【关键词】直肠肿瘤;神经内分泌肿瘤;磁共振成像;病理分级
神经内分泌肿瘤(neuroendocrine tumors, NETs)是一组起源于弥漫分布的神经内分泌细胞并具有神经内分泌标志物、能够产生生物活性胺或多肽激素的肿瘤,可发生于消化道、肺、胰腺、咽喉、纵隔、肝、肾、乳腺、宫颈等各部位。起源于胃肠道的NETs最为常见,占所有NETs的2/3。一项全国性多中心流行病学研究显示,2010年中国确诊的直肠NETs患者较2001年增长了近8倍,在NETs中增长最快。直肠NETs的发展、治疗及预后受诸多因素的影响。美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)指南将胃肠胰NETs分为低级别(G1,高分化)、中级别(G2,中分化)及高级别(G3,低分化)3组。不同病理分级、不同临床分期的NETs多采取不同的精准治疗方法。G1和G2级直肠NETs内镜局部切除可以取得与外科全系膜切除术相似的治疗效果,而手术安全性和患者的术后生活质量明显提高;G3级直肠NETs则需根据肿瘤分期以外科手术切除为主。术前精准评价直肠NETs的病理分级,对于治疗方案的拟定与患者预后评估至关重要,MRI是目前直肠肿瘤术前定性与临床分期的最佳影像学检查手段。因此,在本研究中,我们探讨了直肠NETs的MRI特征和临床特征对病理分级的预测价值,构建了预测模型,以期在术前精确预测直肠NETs的病理分级,为临床治疗方案的拟定提供帮助。
一、病例资料
回顾性收集2013年1月至2019年11月在中国医学科学院肿瘤医院经病理证实的直肠NETs患者30例。入组标准:(1)经肠镜或手术病理确诊为直肠NETs;(2)术前进行了盆腔MRI检查及胸腹部CT检查,且检查与手术间隔时间不超过30 d;(3)影像检查前未进行任何抗肿瘤治疗;(4)临床、影像及病理资料完整。30例患者中,男19例,女11例,年龄34~81岁,中位年龄54岁。
二、临床观察指标
包括患者性别、年龄、术前肿瘤标志物癌胚抗原(carcinoembryonic antigen, CEA)和糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)水平。根据我院采用的检测方法,CEA的正常值范围为0~5 ng/ml,CA19-9的正常值范围为0~37 U/ml。
三、MRI检查方法
1.检查前准备:
应用3.0T GE Discovery MR 750或者Signa Pioneer磁共振检查仪,8通道专用线圈。检查前2~3 h用开塞露行肠道清洁准备。检查前30 min肌肉注射山莨菪碱10 mg以缓解肠道蠕动,有颅内高压、严重心脏病、青光眼及前列腺增生等禁忌证者除外。患者仰卧于检查床,经肛门注入超声耦合剂约60~80 ml。
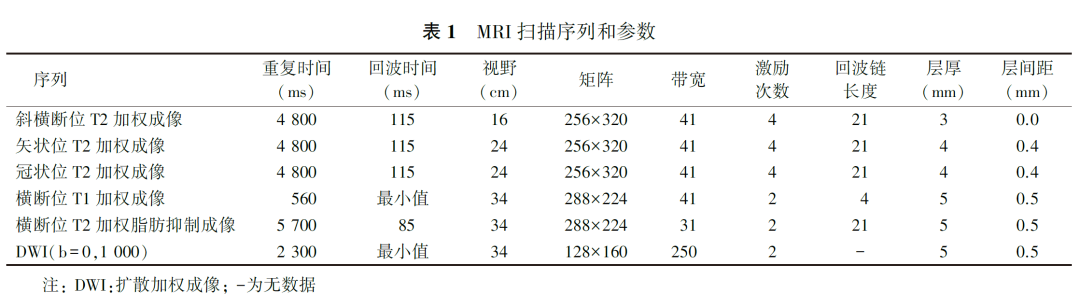
2.检查序列与参数:
包括斜横断位、矢状位高分辨T2加权成像,横断位覆盖全盆腔T1加权成像、T2加权脂肪抑制序列及扩散加权成像,肿物位于直肠下段者加扫冠状位高分辨T2加权成像。具体序列及扫描参数见表1。
四、MRI图像分析
由两位从事腹部MRI诊断15年以上的高年资影像医师共同阅片,并达成一致意见。肿瘤的定性评价指标包括:(1)肿瘤位置:分为直肠上、中、下段,肿瘤下缘距肛门分别为>10 cm、5~10 cm和<5 cm。(2)肿瘤边界:分为清楚、不清楚。(3)肿瘤生长方式:包括腔内生长、跨壁浸润、壁外浸润。(4)mr-T分期:以高分辨T2加权成像及扩散加权成像(diffusion weighted imaging, DWI)为主要评价序列,根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)指南(第8版)进行T分期:T1期:肿瘤侵犯并局限于黏膜下层;T2期:肿瘤侵犯固有肌层;T3期:肿瘤穿透固有肌层达浆膜下或直肠系膜;T4期:肿瘤侵犯浆膜或邻近器官。(5)mr-N评价:参照欧洲胃肠和腹部放射学会(European Society of Gastrointestinal and Abdominal Radiology, ESGAR)的推荐标准,转移淋巴结定义为:①短径≥9 mm;②短径为5~8 mm,同时满足2个及以上形态学指标;③短径<5 mm,同时满足3个形态学指标;④含黏液信号的淋巴结(无论大小)。可疑转移淋巴结的形态学指标包括淋巴结呈圆形、边缘不规整或内部信号不均匀。(6)壁外血管侵犯(extramural vascular invasion, EMVI)及系膜筋膜(mesorectal fascia, MRF)状态的评价:参照ESGAR的推荐标准。(7)T2加权成像信号和DWI信号强度:以正常肠壁信号为参照,T2加权成像信号分为低信号、等信号及高信号,DWI信号分为等信号和高信号。(8)增强后动脉期、静脉期及延迟期强化程度:以T1加权成像平扫信号为参照,分为高强化、低或无强化。(9)远处转移:依据胸腹部CT图像,包括远处淋巴结转移和器官转移。肿瘤的定量指标为肿瘤最大径,在斜横断位和矢状位高分辨T2加权图像选择肿瘤最大层面进行测量。
五、病理分级
根据2019年WHO分类标准和中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)神经内分泌肿瘤专家委员会公布的中国胃肠胰神经内分泌肿瘤专家共识对NETs进行分级。
六、统计学方法
应用SPSS 22.0软件进行统计分析。连续性变量以x̅±s表示,多组间比较采用方差分析;分类变量以频数表示,多组间无序分类变量比较采用Fisher精确概率法的拓展方法Freeman-Halton检验,多组间有序分类变量比较采用Kruskal-Wallis H检验。对有统计学意义的预测特征行共线性检验,容忍度<0.1或方差膨胀因子(variance inflation factor, VIF)>10提示存在共线性。通过逐步回归法移除共线性特征,进入和移除标准分别为P<0.05和P>0.10,最终筛选得到最优变量子集纳入有序多分类logistic回归分析并建立模型。采用受试者工作特征(receiver operating characteristic, ROC)曲线下面积(area under curve, AUC)、灵敏度和特异度评价模型对直肠NETs病理分级的预测效能。显著性检验均为双侧检验,检验水准α=0.05。
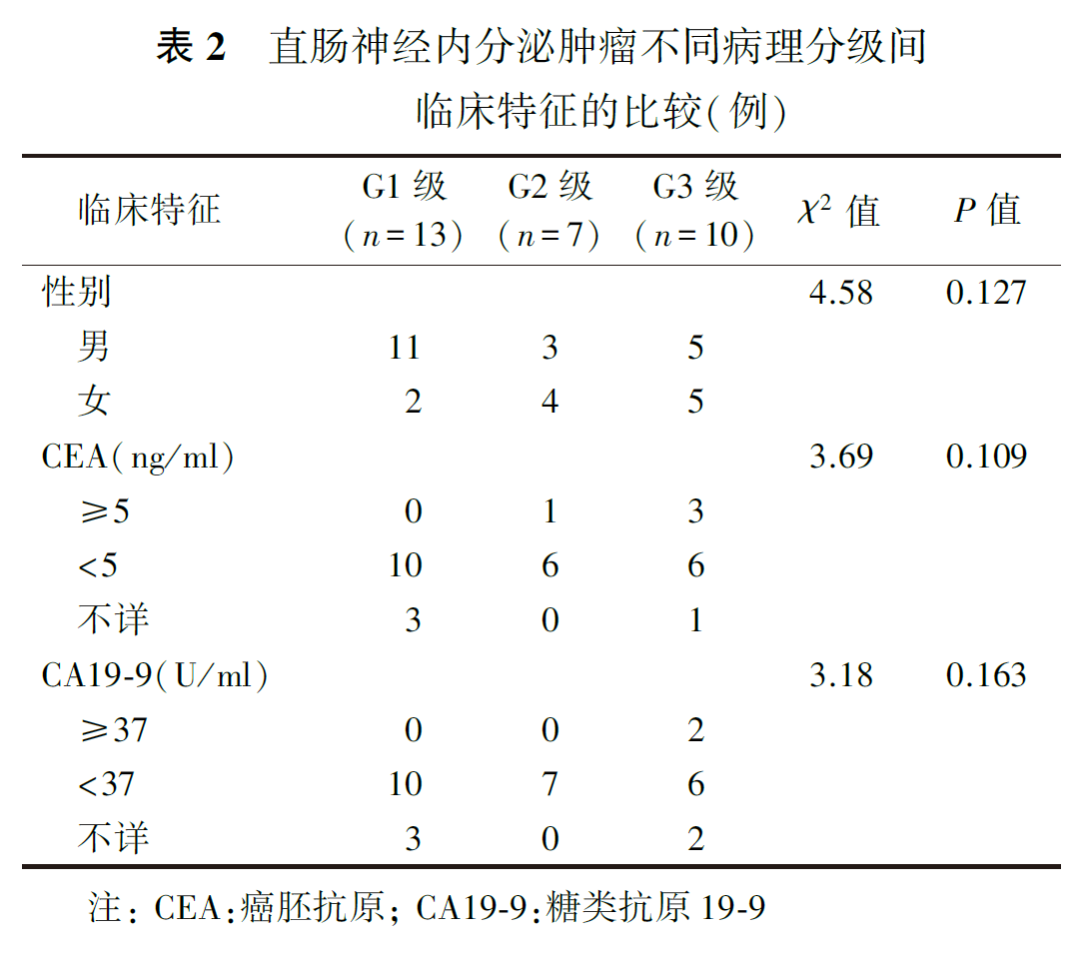
一、直肠NETs不同病理分级间临床特征的比较
30例直肠NETs中,病理分级为G1级13例,G2级7例,G3级10例。由表2可见,G1、G2和G3级患者的性别、治疗前CEA及CA19-9水平差异均无统计学意义(均P>0.05)。G1、G2和G3级患者的年龄分别为(52.69±12.20)、(54.29±9.21)和(53.00±10.54)岁,差异亦无统计学意义(F=0.05,P=0.952)。
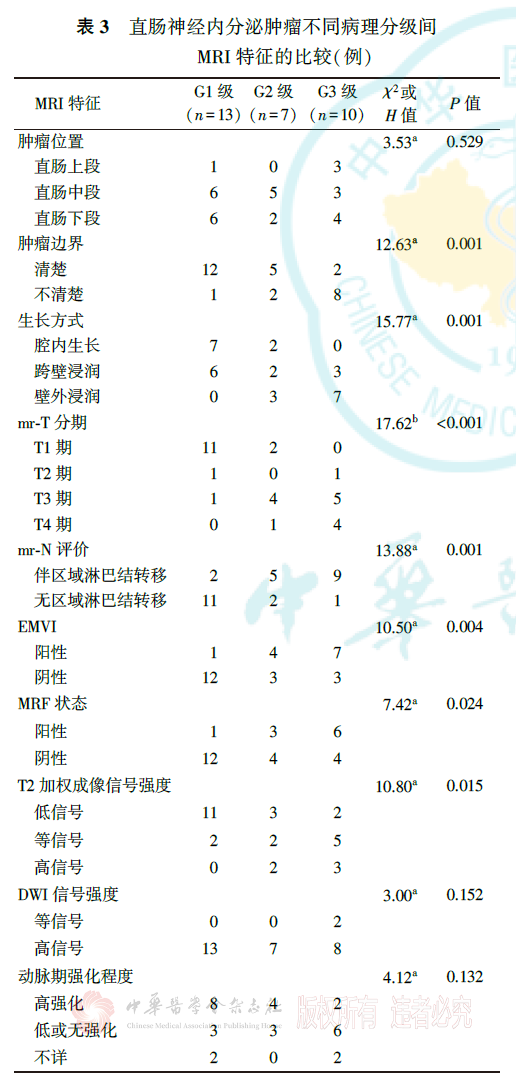
二、直肠NETs不同病理分级间MRI特征的比较
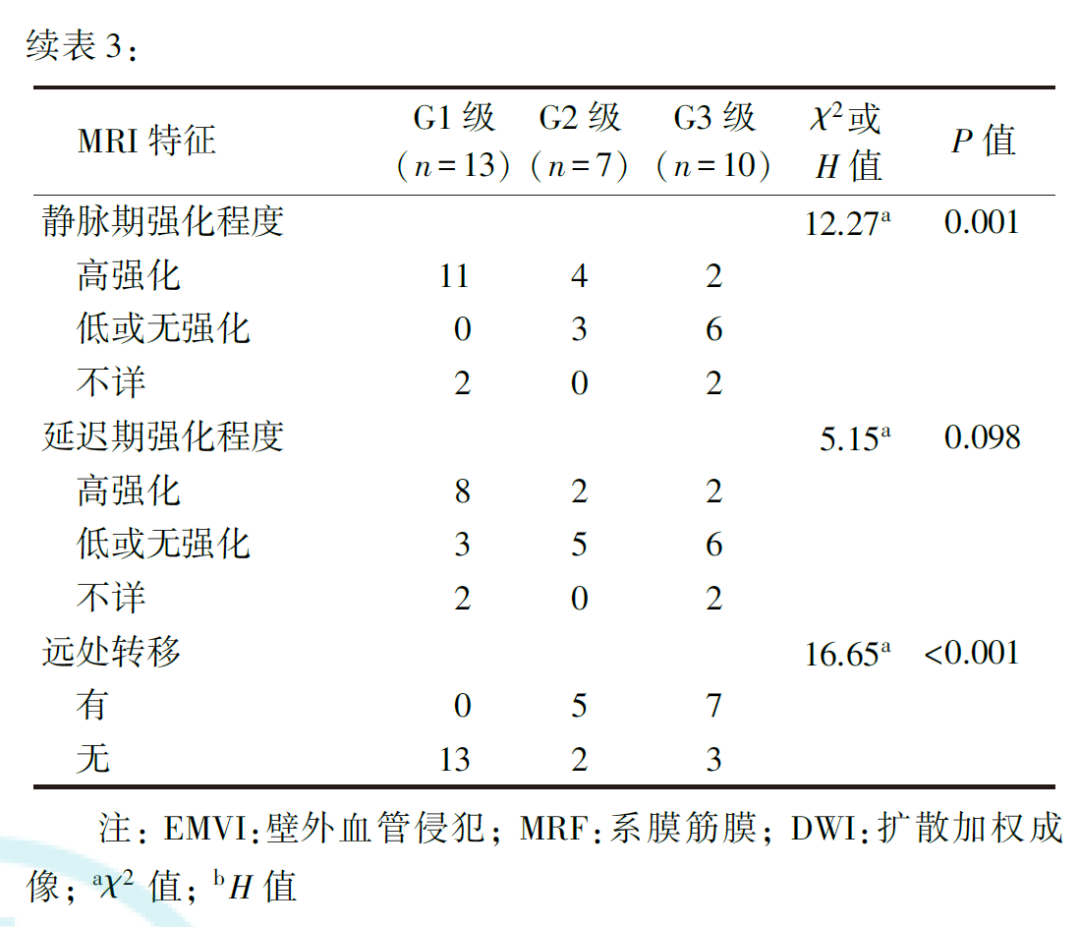
G1、G2和G3级直肠NETs的肿瘤边界、生长方式、mr-T分期、mr-N评价、EMVI、MRF状态、T2加权成像信号强度、静脉期强化程度和有无远处转移差异均有统计学意义(均P<0.05),而肿瘤位置、DWI信号强度、动脉期及延迟期强化程度差异无统计学意义(均P>0.05,表3)。G1、G2和G3级直肠NETs的肿瘤最大径分别为(10.23±6.15)、(36.14±13.48)和(41.70±25.33)mm,差异有统计学意义(F=11.80, P<0.001)。
三、直肠NETs病理分级预测模型的构建
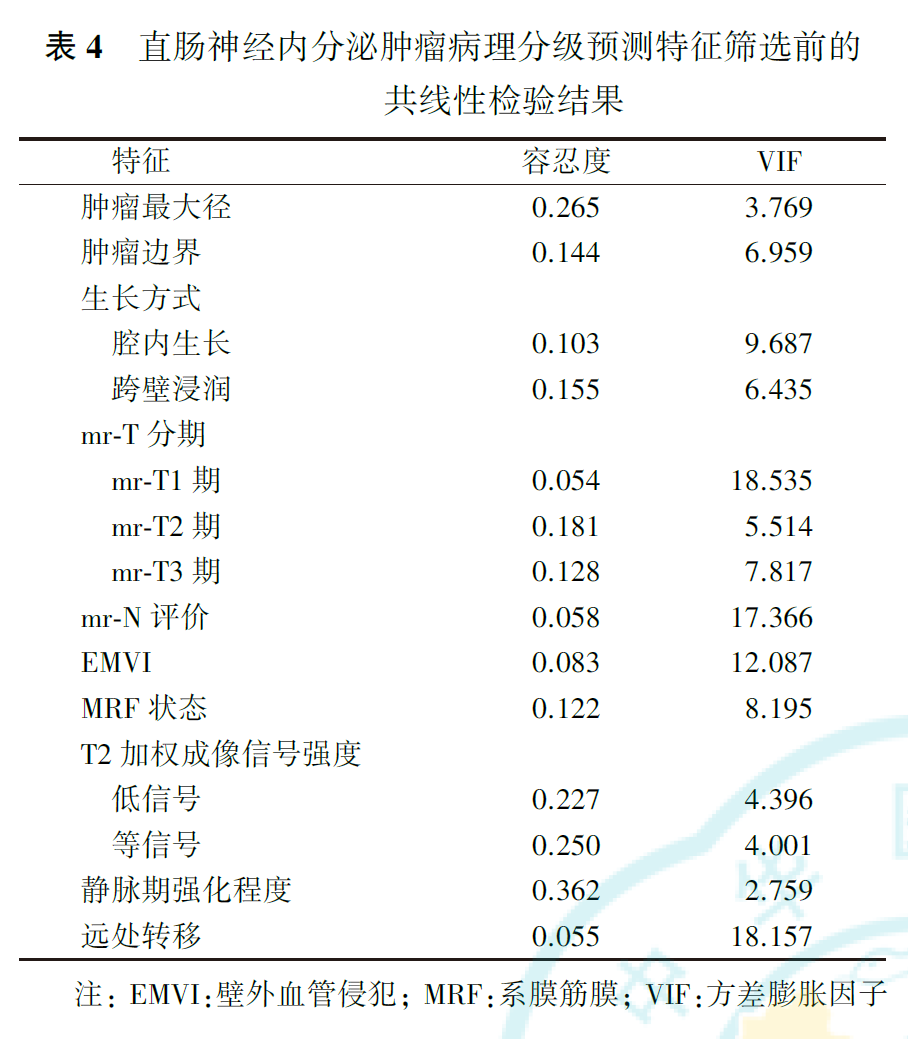
共线性检验结果显示,直肠NETs不同病理分级间差异有统计学意义的特征存在较明显的共线性(表4)。通过逐步回归法移除共线性特征,并再次行共线性检验,最终得到包含mr-T分期和静脉期肿瘤强化程度的最优预测子集,再次行共线性检验的结果显示,mr-T分期的容忍度为0.789,VIF为1.268;静脉期强化程度的容忍度为0.362,VIF为2.759。将最优预测子集纳入有序多分类logistic回归预测模型,得到两个方程(表5),即为预测模型。从中可见,mr-T1期、mr-T2期和mr-T3期肿瘤病理分级为低级别的风险分别是mr-T4期的43.95倍、6.07倍和1.54倍,提示mr-T分期越高,直肠NETs病理分级为高级别的可能性越大。静脉期低或无强化肿瘤的病理分级为低级别的风险是明显强化者的0.07倍,提示静脉期低或无强化肿瘤倾向于较高的病理分级。模型的平行线检验结果为χ2=2.14,P=0.709,表明模型满足比例优势假设,各自变量在模型中的回归系数均相等。拟合优度检验显示,Pearson检验及Deviance检验的结果分别为χ2=7.92,P=0.636; χ2=8.42,P=0.587,表明模型拟合较好。模型拟合信息结果为χ2=23.95,P<0.001,表明所构建的预测模型优于常数项模型。
四、直肠NETs病理分级预测模型的预测效能评价
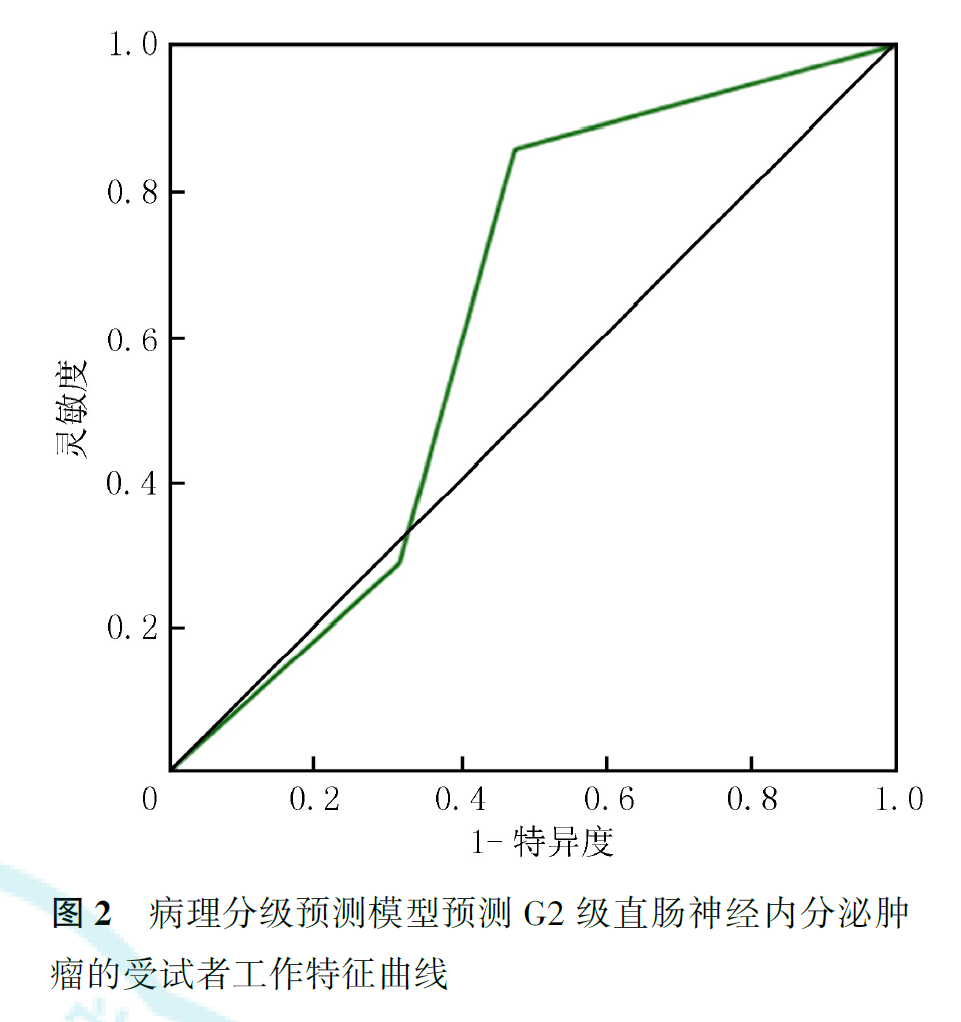
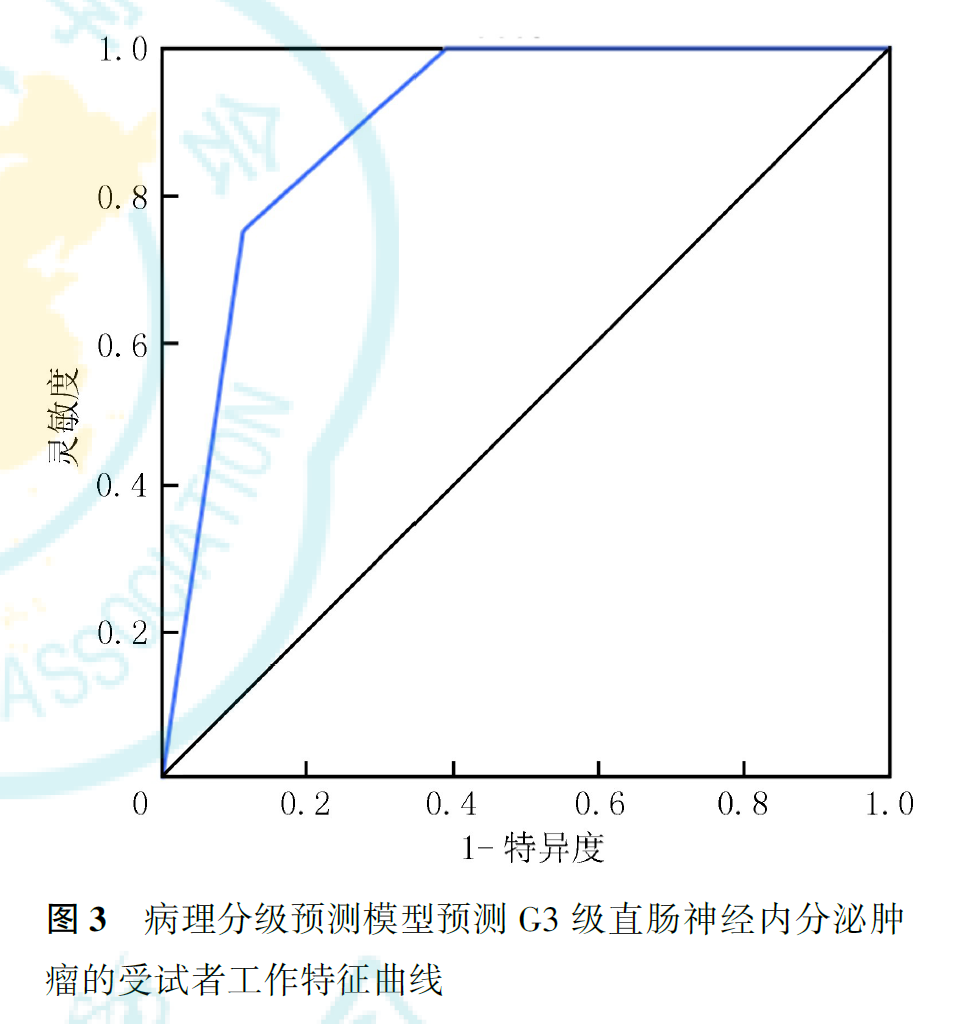
ROC曲线分析显示,预测模型对G1级和G3级直肠NETs的预测效能较高,AUC值分别为0.945和0.896,灵敏度分别为75.0%和90.9%,特异度分别为88.9%和93.3%;对G2级直肠NETs的预测效能较差,AUC值为0.624,灵敏度为85.7%,特异度仅为52.6%(图1,图2,图3)。
直肠NETs起源于肠壁黏膜或黏膜下,大多为非功能性肿瘤,临床表现不典型,起病较为隐匿,约20%的患者在初诊时已经发生转移。2017年,WHO分类标准在2010年版的基础上进行了更新,确定胰腺NETs为恶性或潜在恶性肿瘤,2019年版WHO分类标准进一步将此更新扩展到各种不同组织来源的NETs。有研究显示,G1和G2级胰腺NETs患者的5年生存率分别为75%和62%,而G3级胰腺NETs患者的5年生存率仅有7%。治疗前精准预测直肠NETs的恶性度分级对于选择最佳的治疗方案至关重要。
在本研究中,我们通过分析直肠NETs的临床及MRI形态学指标与病理分级的关系,建立了基于mr-T分期和静脉期强化程度的病理分级预测模型。MRI形态学指标分析结果显示,肿瘤最大径、肿瘤边界、生长方式、mr-T分期、mr-N评价、EMVI及MRF状态与直肠NETs病理分级密切相关。MRI较好的软组织分辨率可以清晰显示肠道较小的肿瘤,小肿瘤多向腔内生长,呈息肉状,而深部侵犯程度较轻,T分期较低,淋巴结转移概率低,提示肿瘤具有较好的分化与较低的肿瘤病理分级(如G1级)。梁振威等分析了37例直肠NETs,也发现随着病变长径的增加,病理分级逐渐增高。随着肿瘤增大,跨肠壁生长,可以浸润黏膜下层,侵犯黏膜下血管、淋巴管,T分期增高,淋巴结及远处器官受侵犯的可能性也增大。既往的文献报道,直径<1 cm的直肠NETs淋巴结转移率仅为1%~10%,1~2 cm的病灶淋巴结转移率约为30%,>2 cm的病灶淋巴结转移率可达到60%。肿瘤增大,分级增高,EMVI、MRF的阳性比例亦增加,肿瘤的边界更加不规则,不清晰。以上这些指标都在不同程度上反映了肿瘤的生物学行为与侵袭程度,但理论上来说,这些形态学参数间的信息存在重叠,如mr-T分期是基于肿瘤大小和浸润程度的评价指标,单一参数肿瘤最大径和生长方式与其存在部分重合。在本研究中,仅保留mr-T分期作为最佳形态学独立预测指标用于病理分级预测模型的构建。与mr-T4期作对照,mr-T1期肿瘤为较低肿瘤病理分级的概率是mr-T4期的43.95倍,mr-T2期是mr-T4期的6.07倍,而mr-T3期仅是mr-T4期的1.54倍。既往也有研究显示,较高的T分期与较差的预后相关,T2期直肠NETs患者的5年生存率可较T1期患者下降约10%。
静脉期肿瘤强化程度是本研究中肿瘤病理分级的另一独立预测指标,静脉期肿瘤低或无强化提示更高级别的病理分级。既往有多项关于胰腺NETs的研究也显示,动脉期或静脉期等或低强化倾向于更高的肿瘤病理分级,这一强化特点也与更差的肿瘤预后相关。然而也有少部分研究得到了相反的结果。Kim等报道,在非明显强化的胰腺NETs中,超过89%的肿瘤为较低的病理分级。吕海娟等的研究结果显示,直肠NETs动脉期强化程度增高提示更高的病理分级。通常来讲,NET细胞通过分泌多种促血管生成因子促进新生微血管形成,从而表现为明显强化。当肿瘤病理分级较低时,肿瘤及肿瘤血管分化程度好,微血管密度高,肿瘤呈明显强化。随着肿瘤病理分级的升高,肿瘤及肿瘤血管分化程度减低,微血管密度降低,肿瘤可以出现坏死囊变,表现为较低强化。d′Assignies等利用灌注CT参数证实了肿瘤的血供与微血管密度、肿瘤病理分级间的密切关联,与本研究结论基本一致。但在本研究中,我们仅发现静脉期强化程度是病理分级的独立预测因素,而动脉期及延迟期强化程度与病理分级无关。此外,高级别肿瘤T2加权成像信号较低级别肿瘤有所增高,这可能与肿瘤增长过快,血供不足,出现坏死囊变有关,与Feng等基于CT的研究结果类似,但T2加权成像信号并非肿瘤病理分级的独立预测因素。
我们构建了基于mr-T分期和静脉期强化程度的直肠NETs病理分级预测模型,取得了较好的预测效能,其预测G1、G2和G3级直肠NETs的AUC值分别达到0.945、0.624和0.896。除G2级肿瘤的预测特异度较低外,预测其他两个级别的灵敏度和特异度均较好。这提示G2级肿瘤的MRI特征与G1和G3级之间存在着一定程度的重叠,可能需要与其他更具特异性的指标相结合才能在临床上进行更准确的判断。总体而言,本模型可以为临床制定精准的治疗方案与评估患者预后提供参考。
发生区域淋巴结转移或远处转移的NETs多为恶性度和分级较高的肿瘤。Sohn等的研究显示,G1级直肠NETs的淋巴结转移率为6%,而G2级病灶淋巴结转移率可升至75%。Ito等的研究显示,G1、G2级胃肠道NETs发生远处转移的概率为2.7% ,而G3级胃肠道NETs发生远处转移的概率高达32.3%。本组患者中,G1、G2、G3级直肠NETs发生淋巴结转移的比例分别为15.4%、71.4%与90.0%,3组间差异有统计学意义;发生远处转移的比例分别为0、71.4%和70.0%。淋巴结转移与远处转移均提示较高的病理分级,但在本研究中二者均非肿瘤病理分级的独立预测因素。
本研究尚存在一定的局限性。本研究为回顾性研究,不可避免地存在病例选择的偏倚。另外,入组病例数较少,可能会对统计结果有一定影响。
总之,术前对直肠NETs的病理分级进行精准评估,对于治疗方案的拟定及预后评价至关重要。我们基于MRI形态学指标,构建了直肠NETs的术前病理分级预测模型,有助于指导临床治疗决策。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


